L'Axe Muscle-Cerveau : Communication Biochimique et Implications pour la Santé Cognitive
Les muscles et le cerveau dialoguent grâce aux myokines : découvre comment l’exercice physique protège la cognition et ralentit le vieillissement cérébral, et pourquoi préserver sa masse musculaire est crucial pour la santé mentale.
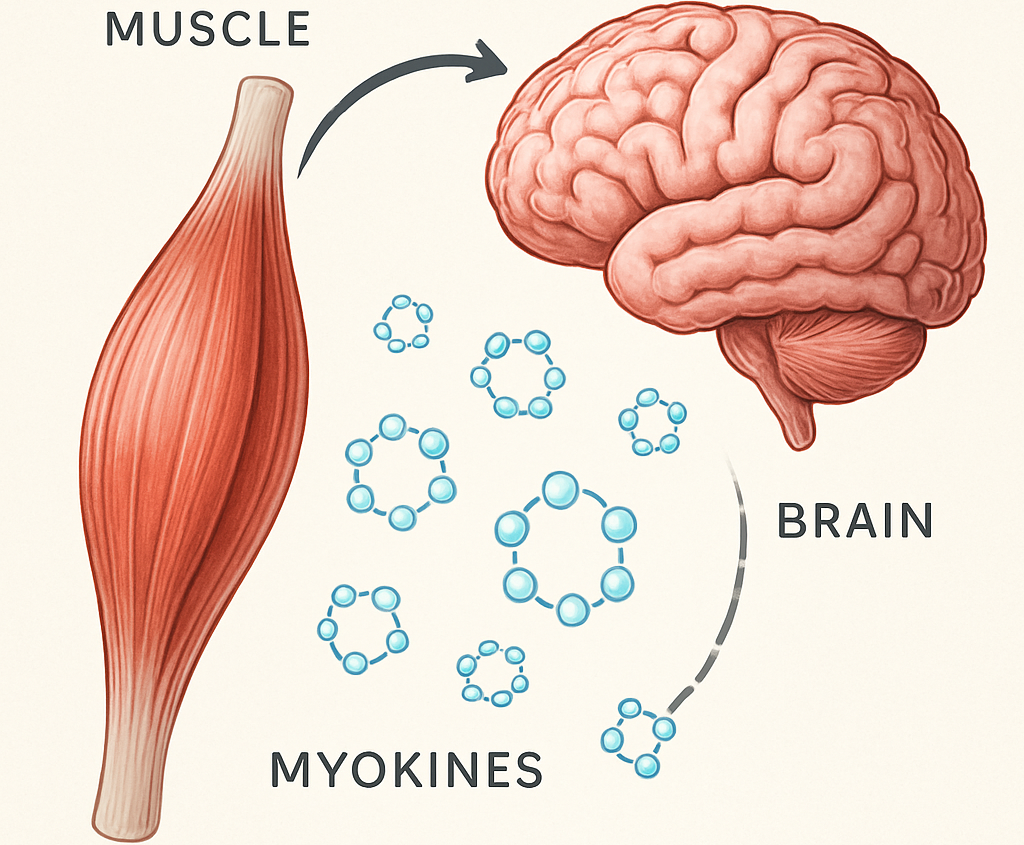
L'interaction entre le muscle squelettique (muscle strié, volontaire, attaché aux os par des tendons et responsable des mouvements du corps) et le cerveau constitue un domaine de recherche établi depuis plusieurs décennies, mais notre compréhension de ses mécanismes moléculaires s'est considérablement approfondie ces dernières années. Cette communication bidirectionnelle, orchestrée par des molécules de signalisation appelées myokines, joue un rôle crucial dans le maintien des fonctions cognitives au cours du vieillissement.
Mécanismes Fondamentaux de la Communication Muscle-Cerveau
Le muscle squelettique, traditionnellement considéré comme un simple effecteur du mouvement, s'est révélé être un véritable organe endocrine. Lors de contractions musculaires, particulièrement pendant l'exercice physique, les fibres musculaires libèrent une variété de facteurs bioactifs dans la circulation systémique [Wang et al., 2018]. Ces myokines peuvent traverser la barrière hémato-encéphalique et exercer des effets directs ou indirects sur le tissu neural [Delezie & Handschin, 2018].
Myokines Bénéfiques
Le BDNF (Brain-Derived Neurotrophic Factor) représente l'un des médiateurs les plus étudiés de cet axe. Produit à la fois par le muscle et le cerveau, il favorise la neuroplasticité (capacité du cerveau à modifier ses connexions et son organisation en réponse à l’expérience, l’apprentissage ou une lésion), la synaptogenèse (formation de nouvelles synapses entre neurones, particulièrement active durant le développement et présente à l’âge adulte) et la survie neuronale [Scisciola et al., 2021]. L'exercice physique augmente significativement sa production musculaire et sa concentration cérébrale, contribuant aux effets neuroprotecteurs de l'activité physique.
L'irisine, dérivée du clivage d'une protéine, constitue une myokine spécifiquement induite par l'exercice [Han et al., 2023]. Elle stimule l'expression de BDNF dans l'hippocampe et protège contre les dysfonctionnements cognitifs dans les modèles animaux de maladie d'Alzheimer. Sa déficience génétique abolit les effets cognitifs bénéfiques de l'exercice, soulignant son rôle central dans cette communication inter-organes.
L'IGF-1 (Insulin-like Growth Factor-1), principalement produit par le foie mais également par le muscle, traverse efficacement la barrière hémato-encéphalique et supporte la neurogenèse hippocampique (production de nouveaux neurones dans l’hippocampe, impliquée dans la mémoire et la plasticité cérébrale) ainsi que l'expression de BDNF [Wang et al., 2018].
Facteurs à Double Action
Plusieurs myokines présentent des effets contextuels dépendants. L'IL-6 (Interleukine-6), par exemple, exerce des propriétés anti-inflammatoires lorsqu'elle est libérée de manière aigüe par la contraction musculaire, mais devient pro-inflammatoire lors d'élévations chroniques liées à la sédentarité ou au vieillissement [Han et al., 2023].
La cathepsine B, sécrétée par le muscle durant l'exercice, peut franchir la barrière hémato-encéphalique et stimuler l'expression de BDNF hippocampique, améliorant la mémoire spatiale [Delezie & Handschin, 2018]. Cependant, son accumulation dans la microglie (cellules immunitaires résidentes du système nerveux central, responsables de la surveillance, de l’inflammation et de l’élimination des débris) âgée contribue à la neuroinflammation et au déclin cognitif.
Facteurs Délétères
La myostatine (GDF-8), régulateur négatif de la croissance musculaire, présente des niveaux élevés dans la sarcopénie et est associée à l'accélération du déclin cognitif [Han et al., 2023]. Sa suppression génétique dans des modèles murins de maladie d'Alzheimer améliore à la fois la masse musculaire et les performances cognitives.
Le GDF-15 (Growth Differentiation Factor-15), biomarqueur du stress cellulaire, s'élève avec l'âge et corrèle positivement avec le risque de démence et la sévérité de la sarcopénie [Han et al., 2023].
Implications Cliniques : Sarcopénie et Déclin Cognitif
Des études épidémiologiques robustes établissent une association indépendante entre sarcopénie et altérations cognitives. Une méta-analyse récente incluant plus de 18 000 participants démontre que la sarcopénie augmente de 75% le risque de troubles cognitifs [Chen et al., 2022]. Cette association persiste après ajustement pour l'âge, le niveau d'éducation, et les comorbidités, suggérant un lien causal.
Les analyses statistiques confirment cette relation causale, indiquant que la réduction de la masse musculaire accélère le vieillissement cérébral, particulièrement dans des régions comme l'hippocampe et le cortex préfrontal [Arosio et al., 2023]. L'activité physique émerge comme médiateur modifiable de cette relation, offrant une cible thérapeutique prometteuse.
Mécanismes Neuroprotecteurs de l'Exercice
L'exercice physique, qu'il soit aérobie ou en résistance, active de multiples voies moléculaires bénéfiques pour la santé cérébrale. L'exercice aérobie stimule l'expression de BDNF et favorise la survie neuronale [Wang et al., 2024]. L'exercice en résistance active des voies différentes, promouvant la synthèse protéique neuronale et la plasticité synaptique.
Ces mécanismes convergent vers l'amélioration de la fonction mitochondriale cérébrale, la réduction du stress oxydatif, et l'atténuation de la neuroinflammation. L'exercice régulier maintient l'intégrité de la barrière hémato-encéphalique et favorise l'angiogenèse cérébrale (formation de nouveaux vaisseaux sanguins dans le cerveau, favorisant l’apport en oxygène/nutriments et la plasticité) induite par les myokines [Delezie & Handschin, 2018].
Perspectives Thérapeutiques
La compréhension de l'axe muscle-cerveau ouvre de nouvelles avenues thérapeutiques pour prévenir ou traiter le déclin cognitif. Des approches ciblant spécifiquement le muscle pourraient bénéficier aux fonctions cérébrales :
- Modulation pharmacologique des myokines : développement d'agonistes d'irisine ou d'inhibiteurs de myostatine
- Thérapies géniques musculaires : surexpression de neprilysine ou d'anticorps anti-amyloïde dans le muscle
- Stimulation électrique fonctionnelle : induction de contractions musculaires chez les patients non ambulatoires
L'exercice physique reste néanmoins la stratégie la plus efficace et accessible, particulièrement l'exercice combiné (aérobie + résistance) qui optimise la sécrétion de myokines bénéfiques tout en minimisant les facteurs délétères [Han et al., 2023].
Conclusion
L'axe muscle-cerveau représente un système de communication sophistiqué où le muscle squelettique agit comme un organe endocrine modulant directement la santé cérébrale. Cette découverte transforme notre approche de la prévention du déclin cognitif, positionnant le maintien de la masse et de la fonction musculaires comme priorités de santé publique. Les interventions ciblant cet axe, particulièrement l'exercice physique régulier, constituent des stratégies prometteuses pour promouvoir un vieillissement cognitif réussi.
Sources :
- Delezie, J., & Handschin, C. (2018). Endocrine crosstalk between skeletal muscle and the brain. Frontiers in Neurology, 9, 698. https://www.frontiersin.org/journals/neurology/articles/10.3389/fneur.2018.00698/full
- Han, X., Ashraf, M., Tipparaju, S. M., & Xuan, W. (2023). Muscle–Brain crosstalk in cognitive impairment. Frontiers in Aging Neuroscience, 15, 1221653. https://www.frontiersin.org/journals/aging-neuroscience/articles/10.3389/fnagi.2023.1221653/full
- Scisciola, L., Fontanella, R. A., Surina, et al. (2021). Sarcopenia and cognitive function: Role of myokines in muscle brain cross-talk. Life, 11(2), 173. https://www.mdpi.com/2075-1729/11/2/173
- Wang, B., Liang, J., Lu, C., Lu, A., & Wang, C. (2024). Exercise regulates myokines in aging-related diseases through muscle-brain crosstalk. Gerontology, 70(2), 193-209. https://karger.com/ger/article/70/2/193/870306/Exercise-Regulates-Myokines-in-Aging-Related